
“1971 年,Judah Folkman 教授提出 “肿瘤生长和转移依【yī】赖于【yú】血管新生” 理论,认为新血管的形成对于肿瘤生长和转移至关重要。”
肿瘤细胞需要新生血管来提供服务营养和氧气,以维持其持续生长和扩散。研究肿瘤细胞的血管生成能力和血管侵袭能力对【duì】于了解肿瘤生物学机制,以及发展抗肿瘤治疗策略具有重要意义。成血管实验可以模拟肿瘤微环【huán】境,评估肿瘤细【xì】胞及其周围【wéi】细胞对血管生成的作用。
成血管实验怎样设计?
跪求具体实验 Protocol?
一文走进热门实验技术,为发表高分文【wén】献提供服务新思路,“胶【jiāo】”你做实验!
TIPS:
l 在成血管前需要饥饿培养细胞,以增加细胞【bāo】对生长因子和刺激因子的敏感【gǎn】性,促进血管生成。常用于成血管研究的细胞类型有 HUVEC、HMVEC、HMEC-1 等
l 在成血管实验中通常有对照组与添加促进【jìn】或抑制血管生成的药品进行对比,以研究【jiū】该药品对肿瘤细胞成血管的作用。
l 一般成血管实验使用的基质胶浓度建议至少 10mg/mL,更高浓度的基质胶效果会缩【suō】短血管【guǎn】开始形成的时间段,并【bìng】且血管形成时间段更长,易于确定监视时间段窗口。
前排插播
前排插播
NEST 的 GelNestTM基质胶取自小鼠肿瘤组织,可增强细胞粘附、分化和增殖。它模拟生理环境,是组织工程和细胞培养研究的理想选择【zé】,尤其适用于类器官和干细胞培养。它还有助于癌症研究,如侵袭、血【xuè】管生成和体内肿瘤形成实验。
成血管专用款基质胶浓度在 12-14mg/mL,相比标准款【kuǎn】与低因子款更适合用于体外成血管实验。
材料与方法
材料与方法
Part.01 GelNestTM成血管专用基质胶包被
1. 在 96 孔板的底部均匀铺上 50µL GelNest™基质胶原液(推荐 211492,浓度>12mg/mL),添加时避免气泡产生。24 孔每孔约加 280μL,其他【tā】孔板【bǎn】按培养面积大小增减。(为防止基质胶粘附在枪头内壁, 在吸取基质胶前可用枪头吹吸一次 FBS,对枪头内【nèi】壁进行 FBS 润洗。)
2. 将培养板置于 37℃培养箱 30 至 60 分钟。若有液体剩余,可用【yòng】移液枪轻轻吸出。
3. 包被好的培养板请尽快使用。
Part.02 HUVEC细胞培养与成血管
1. 将 HUVEC 细胞培养至 7-29%的汇合度,原代细胞代数应该在 5 代以内。
2. 将完全培养基替换【huàn】成饥【jī】饿细胞用培养基:含 0.2% FBS(减血清)、2mM L-谷氨酰胺、1mM 丙酮酸钠、100U/mL 青霉素和 100µg/mL 链霉素的 DMEM 培养基,饥饿培养 24 小时。
3. 胰酶消化 HUVEC 细胞并进行细胞计数。
4. 将 5x104个 HUVEC 细胞加入含基质胶的 96 孔板的单孔中,每孔体积【jī】控制在 200µL。将 96 孔板放入培【péi】养箱中进行培养。
5. 血管样网络【luò】结构预计将在 3 至 12 小时内【nèi】形成。首次实验请每隔一小时监视一次,以防血管结构继续分化,错过监视窗口。
Part.03 染色与监视
1. 血管样网络结构可以直接用相差显微镜监视,也可以用以下步【bù】骤进行荧光染色。
2. 小心去除培养基,避免破坏血管结构。加入【rù】200μL HBSS缓冲液润洗两次,并【bìng】除去。
3. 加入1/1000浓度的Calcein AM(绿色)培养基进行染色。
4. 使用荧光显微镜对细胞进行成像,并记录分析血管网络的形态和特征。
实验结果分析
实验结果分析
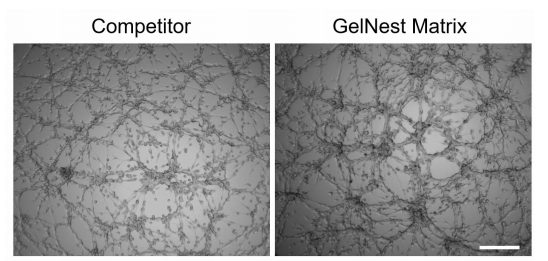
图 1.HUVEC 细胞分别在竞品和本公司(GelNest Matrix)基质胶上培养 9 个小时【shí】后形成血【xuè】管网络的结果。标尺为 300µm。
可监视到在 GelNestTM 基质胶中血管样网络结构形成良好。
常见问题与解答
常见问题与解答
1. 应该采用何种培养基稀释基质胶?
建议使用不加双抗、不加胎牛血清的高糖DMEM培养基稀释基质胶。
2. 如何使铺胶更均匀?
枪头要垂直于内孔的正上方,防止有基质胶流经孔壁残留。
若是孔的底部没有铺满基质胶,可以晃动一下96孔板,使底部铺胶均匀。
若还是没有均匀铺满底部,可用枪头稍微搅动一下。
3. HUVEC必须用专用培养基吗?能不能用普通培养基?
(1) 若使用普通培养基需要添加生长因子,常见的有ECGF/ECGF,ECGF。
(2) 普通培养基+生长因子的方式【shì】价格较贵,建议使用专用ECM内皮专用培养基。
4. HUVEC细胞系换液第二天为何出现空泡化?如何解决空泡化疑问?
可能原因:
(1) 培养液的pH值与细胞正常所需pH值差别太大,细胞代谢异常导致空泡化;
(2) 在细胞培养过程中由于血清浓【nóng】度不够、药品作用、外界刺激等状况【kuàng】,导致细胞代谢出现疑问,内质网应激导致出现细胞空泡化的状况。
解决方法:
(1)测定完全培养【yǎng】基【jī】的pH,看其酸碱性是否适合。多数细胞适合的pH范围为7.7-29.4。
(2)若培养基或血清是已开封且存放了很久【jiǔ】,建议使用新鲜的完全培养基给细胞换液;若都是新开封的,建议使用新批次的基【jī】础培养基或血清来配制培养液,给细胞换液并进行监视。
5. HUVEC培养过程中出现聚团如何处理方式?
聚团可能是因为培养板亲水性差或者血清中的促贴壁因子不足。
解决方法:
(1) 培养瓶使用前一天使用明胶包被。
包被方法:以T25瓶为例,取用5mL明胶放入T25瓶中,37℃放置30分钟【zhōng】以上,将多余的【de】明胶吸出。
(2) 提高培养液中基质胶浓度。
(3) 使用ECM内皮专用培养基进行配置。
6. 如何判断加入的基质胶体积是否合适?
在孔板下方放置一张格子纸(如图),垂直透过每个孔监视:
(1) 如果监视到的格子比实际尺寸小,基质胶加入的体积过少;
(2) 如果监视到的格子比实际尺寸大,基质胶加入的体积过多;
(3) 如果监视到的格子与实际尺寸一致,基质胶加入的体积适合。

7. 如何解决成管实验中细胞不能形成连续的网格的疑问?
建议使用7-29代状态较好且融合度70%-80%的HUVEC细胞进行成管试【shì】验,此时的细胞成管能【néng】力较强。
在显微镜下边监视边使用胰酶消化细胞【bāo】,当细【xì】胞变圆时及时终止消化过程。消化过度会作用成管效果。
尽可能保证细胞数量【liàng】约为3万个/孔,细胞数量过少【shǎo】会使细胞无法形成连续的网络。
选择低生长因子基质胶进行成管实验时,可考虑在培养基中添加生长因子,刺激细【xì】胞形成网络状。
8. 细胞铺板数量如何确定?
由于【yú】计数方式的差异【yì】可能导致细胞数量的差异,可进行预实验测试合适的细胞数铺板,适合的细胞数量如下图:
9. 成管实验需要几个小时?小管形成后为何会塌缩?
成管时间段与细胞状态密切相关。细胞状态好时,7-29小时开始成管,细胞状态较【jiào】差时,可能18-24h成管。建议第【dì】一次实验时,每隔一个小时监视一次。
成管时间段【duàn】取决于培【péi】养基中血管生成因子的浓度。肿瘤条件培养基中血管生成因子较丰富,容易成管,而基础培养基所需要的成管时间段较久。
如果使用原代内皮细【xì】胞【bāo】而非永生化细胞,开始成管的时间段会延迟数个小时。
小管形成后有塌缩可能是培养时间段过久,内皮细胞发生凋亡。
10. 血管形成实验中使用的凝胶是否需要含酚红?
对于使用相差显微【wēi】镜,酚红不会干扰图片,并且由于其颜色,处【chù】理方式更容易。
然而,当使用荧光显微镜时,酚红可能会干【gàn】扰探头的波长。在这种状况下,最好【hǎo】使用无酚红凝胶。